Eppendorf 艾本德中国品牌商
17 年
手机商铺
- NaN
- 0
- 1
- 2
- 1
推荐产品
公司新闻/正文
核心变革,重塑未来|病毒载体如何引领基因治疗新突破?
467 人阅读发布时间:2025-02-06 13:38
病毒载体在基因治疗中扮演着极其重要的角色,它们能够有效地将外源性遗传物质或基因编辑酶(如 CRISPR-Cas9 复合物)递送至目标细胞内,实现目标基因的表达或修复。这种技术利用了病毒天然具有的感染细胞并传递遗传信息等物质的能力,但在此之前会去除病毒的致病成分,确保其安全性和有效性。截止目前,国内外合计已有几十款基于病毒载体的体内外基因治疗药物获批上市。
图 1:病毒载体的开发与生产对于基因治疗发展愈发显得重要
尽管病毒载体在基因治疗领域应用方面已取得了显著成就,但其潜在的风险(如高剂量给药引发的免疫毒性、插入突变导致的致癌风险)和生产成本高昂等问题仍然需要解决,未来研究将致力于病毒载体开发与生产工艺等方面的优化和创新,以获得更安全、更高效及更低生产成本的病毒载体系统。
基因编辑形式多,病毒载体的选择与构建至关重要
根据治疗目选择合适的病毒载体类型,常见的有 AAV、腺病毒(Ad)与逆转录病毒(或慢病毒)等。此外,需要对相应的载体进行基因元件的设计与优化,确保其能够携带目的基因元件高效进入目标细胞,并在目标细胞中有效表达。除了常见的通过病毒载体实现基因补偿的方式和体外基因编辑细胞进行基因治疗外,研究人员也在探索使用病毒载体搭载基因编辑元件直接进行体内编辑,在患者体内直接修正病变基因,实现更为长期甚至永性的治疗效果,目前该疗法已步入临床试验阶段。
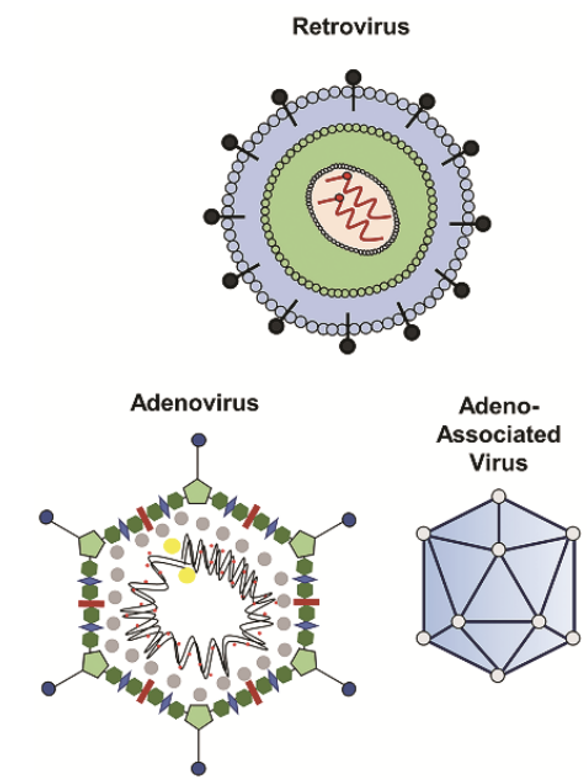
图 2:基因治疗常用病毒载体示意图
降低细胞培养成本,指明未来生产工艺方向
病毒载体生产中常用的细胞系包括 HEK293 及其衍细胞系(如 HEK293T、HEK293F)以及 CHO 细胞系等。目前,用于病毒载体的规模化生产的细胞培养系统主要包括贴壁细胞培养系统和悬浮细胞培养系统。传统的贴壁培养工艺放大难度大,人力成本高,且细胞密度相对低,产量也相对较低。微载体或片状载体培养系统虽能提高细胞产量并减少人力成本,但高效转染困难是其主要缺点。相比之下,悬浮细胞培养技术更能满足临床规模生产的需求。无血清悬浮培养不仅减少了血清的使用,降低了生产成本,还简化了下游纯化技术。因此,开发低成本的悬浮培养生产模式是大规模病毒载体生产工艺未来的发展方向。
在大规模病毒载体生产项目的早期开发过程中,往往需要对用于规模化生产工艺的细胞株进行驯化,一方面可以提高悬浮细胞的适应性和生产性能,确保细胞能够在悬浮培养和无血清或低血清条件下高效生长和表达病毒载体;一方面细胞的驯化还有助于保证产品的质量安全性和一致性,确保生产符合 GMP 标准。通过驯化,细胞系能够更好地适应大规模生产的特殊需求,从而实现高效、经济且可靠的病毒载体生产。
驯化细胞过程中需要对很多参数进行测试和优化,包括培养基成分、细胞密度、转染效率、病毒载体产量等等,这往往需要高通量的实验设计来加速筛选过程,以降低人力物力和时间成本。目前,二氧化碳培养摇床因其便于实验参数的高通量调整和优化,加快工艺开发进程,而被广泛应用于细胞悬浮培养工艺包括悬浮细胞驯化、细胞株筛选等需要高通量参数测试与优化的早期开发中。
为了进一步满足悬浮细胞工艺开发的需要,目前市面上多款二氧化碳培养摇床均相应地做了产品优化,例如:
新型 CellXpert® CS220 CO₂ 培养摇床,拥有 4780 cm² 的超大型摇床板,相较于大多数其他二氧化碳培养摇床,提供了更大的承载量。最多可承载 8 个 5L Corning/Thomson Optimum Growth 培养瓶,25 个 1L 锥形瓶,或 102 个 125 mL 锥形瓶。培养瓶承载量提高多达 40%,可以在相同的空间内进行更多的细胞培养实验,加速研究进程。此外,CellXpert® CS220 是市场上集成 180°C 高温灭菌功能的二氧化碳培养摇床,能够彻底消除污染风险。所有腔体配件和摇床板都能耐受 180°C 的灭菌过程。可通过实验室管理系统或前置 USB 端口,可以筛选并导出性能图表、事件项目等数据,进行远程监控和实时警报通知。
优化病毒载体生产过程的意义
基因治疗病毒载体生产是复杂且关键的过程。在病毒载体方面,需依治疗目选合适类型如 AAV、腺病毒等并优化基因元件;细胞培养上,HEK293 和 CHO 等细胞系常用,悬浮培养是规模化生产趋势,早期要驯化细胞并优化参数。病毒载体生产含转染、培养、纯化质检等多步骤,转染环节关键,不同转染法各具优劣。同时,细胞培养种子扩增中,从冷冻细胞到生物反应器接种物制备要防污染,选好设备与转移方法,在对数生长期传代,优化摇瓶和生物反应器培养参数,强化扩种可提升效率,这些方面的优化对基因治疗发展意义重大。
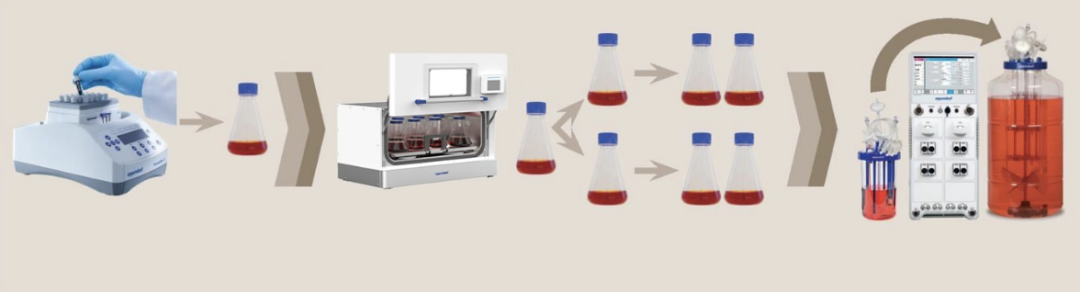
(图 4:哺乳动物细胞培养扩种示例,从摇瓶至生物反应器)